Perkembangan Teori Atom
Perkembangan teori atom telah mengalami kemajuan yang signifikan sejak pertama kali John Dalton mengungkapkan teori atom pada tahun 1803. Sebagian besar pengetahuan tersebut berasal dari hasil beberapa eksperimen dengan tujuan untuk mengungkap detail struktur internal atom. Pada artikel ini, kita akan membahas beberapa perkembangan utama teori atom dengan penekanan pada penerapan metode ilmiah, serta belajar bagaimana bukti eksperimen dianalisis.
Teori Atom John Dalton
Teori atom modern pertama kali di ungkapkan pada tahun 1803 oleh seorang ahli kimia Jhon Dalton yang meletakkan konsep dasar bahwa semua elemen di susun dari atom. Sebelumnya atom dikenal sebagai bagian terkecil dari suatu unsur yang yang mempertahankan identitas dari unsur tersebut. Atom tunggal memiliki ukuran yang sangat kecil. Ukuran atom tersebesar diperkirakan hanya memiliki diameter sebesar 5,4 x 10-10m. Dengan ukuran sebesar itu diperkirakan akan dibutuhkan sebanyak 18 Juta atom berjejer untuk sampai sepanjang 1 cm.

Gambar 1. John Dalton seorang ahli kimia berkebangsaan inggris.
Teori atom John Dalton dianggap sebagai teori atom modern karena konsep tentang atom sebelumnya sudah sangat lama. Konsep atom pertama kali di sampaikan oleh ahli filsuf berkebangsaan Yunani Leucippus dan Democritus pada abad ke lima sebelum masehi. Kata atom berasal dari bahasa Yunani "Atomos" yang memiliki arti tidak dapat dipisahkan atau tidak dapat dibagi-bagi lagi. Namun Dalton memiliki sesuatu yang tidak dimiliki oleh filsuf Yunani sebelumnya yaitu pengalaman eksperimen seperti rumus kimia sederhana dan sifat gas. Bagaimanapun 150 tahun sebelum Dalton telah berkembang metode sains modern yang banyak dilakukan oleh para filsuf untuk mempelajari alam. Sehingga ketika Dalton mengajukan teori atom modern, Ia banyak mengajukan teori fundamental berdasarkan pengamatan mengenai alam semesta, bukan hanya berdasarkan pada diskusi pada ranah filosofi.
Untuk menggambarkan mengenai atom, Dalton mengajukan 6 postulat yaitu:
- Semua materi terdiri dari suatu partikel yang tidak dapat dibagi-bagi lagi yang disebut dengan atom.
- Atom dari unsur yang sama memiliki bentuk dan massa yang sama tetapi berbeda dengan atom dari unsur lainnya.
- Atom tidak dapat diciptakan dan dimusnahkan.
- Atom dari unsur yang berbeda dapat bergabung satu sama lain dengan perbandingan bilangan bulat yang tetap dan sederhana untuk membentuk senyawa campuran atom.
- Atom dari unsur yang sama dapat bergabung dalam lebih satu perbandingan untuk membentuk lebih dari satu senyawa yang berbeda.
- Atom merupakan bagian terkecil dari suatu materi yang dapat mengambil bagian dari suatu reaksi kimia.
Kelemahan Teori Atom Dalton
Berdasarkan kemajuan ilmu pengetahuan dibidang kimia saat ini, teori atom dalton memiliki beberapa kelemahan yaitu:
- Postulat pertama yang menyatakan bahwa atom tidak dapat dibagi lagi adalah salah. Sebuah Atom masih dapat dibagi lagi menjadi proton, neutron dan elektron. Namun demikian atom merupakan bagian terkecil dari suatu partikel yang dapat mengambil bagian dari suatu reaksi kimia.
- Menurut Dalton, Atom-atom dari unsur yang sama adalah serupa dalam segala hal. Namun atom dari unsur yang sama nyatanya masih memiliki perbedaan dalam hal massa dan kerapatannya. Suatu atom yang memiliki perbedaan massa disebut dengan isotop. sebagai contoh unsur klorin memiliki 2 isotop dengan nomor massa 35 dan 37.
- Dalton juga menyatakan bahwa atom dari unsur yang berbeda memiliki perbedaan dalam segala hal. Namun ini juga terbukti salah dalam beberapa kasus. Sebagai contoh atom argon dan kalsium masing-masing memiliki massa yang sama yaitu sebesar 40 amu.
- Berdasarkan postulat Dalton, atom dari unsur yang berbeda dapat bergabung dengan perbandingan bilangan bulat sederhana untuk membentuk suatu senyawa. Namun ini tidak berlaku untuk senyawa organik kompleks seperti gula (C12H22O11).
- Selanjutnya teori atom Dalton gagal menjelaskan keberadaan alotrop (berbagai bentuk unsur murni), dimana tidak memperhitungkan perbedaan sifat dari arang, grafit dan intan.
Akses materi mengenai model-model atom dan struktur atom melalui video pembelajaran berikut:
Teori Atom J.J. Thomson
Jika suatu materi tersusun dari atom, maka atom tersusun dari apa? Apakah atom memang merupakan partikel terkecil atau ada yang lebih kecil? Pada akhir tahun 1980-an, sejumlah ilmuwan yang tertarik dengan pertanyaan diatas melakukan penelitian untuk menyelidiki buangan sinar listrik yang dihasilkan pada tabung bertekanan rendah, dimana penemuan paling populer di lakukan oleh seorang fisikawan inggris J.J. Thomson menggunakan tabung sinar katoda. J.J. Thomson mengunakan sebuah tabung tertutup bertekanan rendah yang berisi dua elektroda logam. Ketika tegangan tinggi diberikan melintasi elektroda, sinar tampak yang disebut dengan sinar katoda muncul melewati anoda. Ketika sinar katoda tersebut di berikan muatan maka sinar tersebut dibelokkan kearah muatan positif dan menjauhi muatan negatif. Peristiwa tersebut berlaku untuk logam yang berbeda dengan perlakukan yang sama. Dengan eksperimen yang serupa sinar katoda tersebut ternyata juga dibelokkan oleh medan magnet. Dengan mengukur tingkat defleksi dan kekuatan medan magnet memungkinkan Thomson untuk menghitung rasio muatan terhadap massa partikel sinar katoda. Berdasarkan pengukuran tersebut dapat diketahui bahwa partikel tersebut jauh lebih ringan dari pada atom.


Gambar 2. (a). J.J. Thomson, (b) Percobaan sinar katoda oleh thomson, (c) Sinar katoda yang dibelokkan oleh medan magnet dan listrik memungkinkan Thomson untuk mengukur rasio muatan terhadap massa yang menyusun sinar katoda.
Berdasarkan pengamatannya J.J. Thomson menarik sebuah kesimpulan (a) Partikel-partikel di tarik oleh muatan positif dan ditolak oleh muatan negatif sehingga partikel tersebut haruslah bermuatan negatif. (b) Partikel-partikel tersebut lebih ringan dari pada atom dan tidak dapat dibedakan terlepas dari bahan sumbernya sehingga partikel tersebut haruslah menjadi konstituen dasar penyusun dari semua atom. Meskipun kontroversial pada saat itu, secara bertahap hasil penelitian Thomson dapat diterima dimana partikel sinar katoda merupakan apa yang kita sebut dengan elektron yaitu partikel subatom bermuatan negatif yang memiliki massa lebih dari seribu kali lebih kecil dari pada massa atom. Istilah elektron pertama kali diciptakan oleh fisikawan irlandia George Stoney pada tahun 1891 dari kata "electric ion".
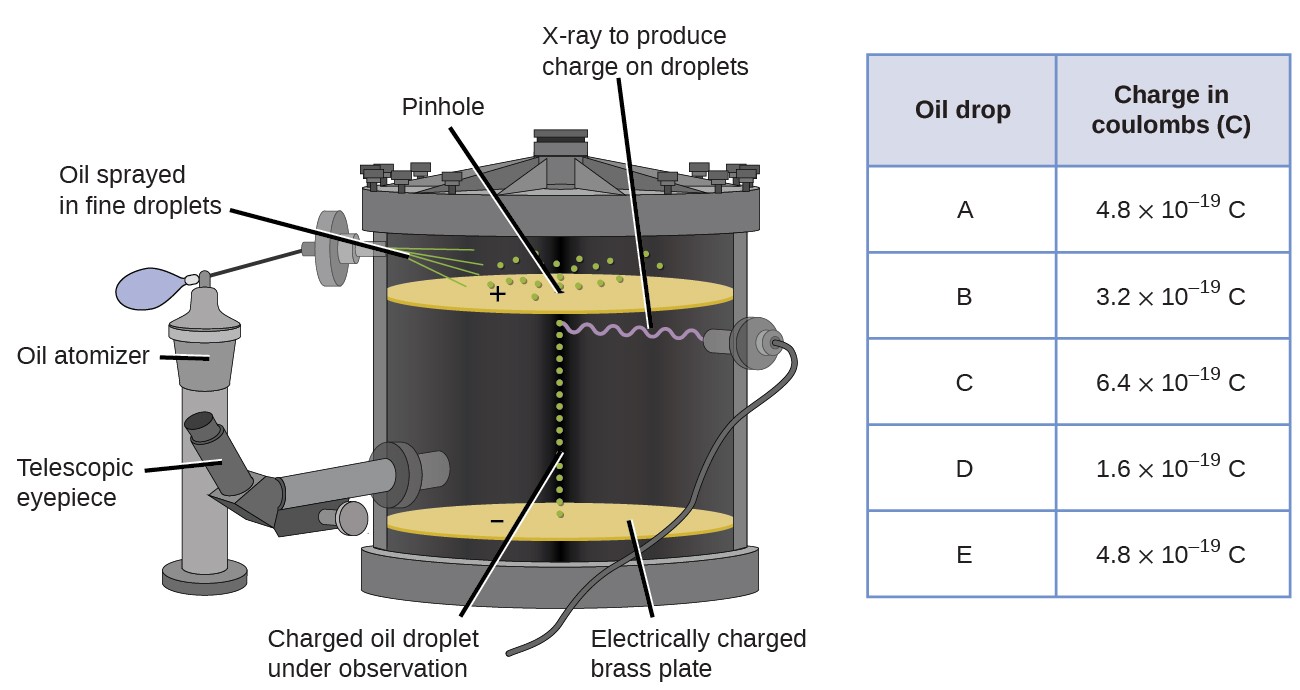
Pada tahun 1909, seorang fisikawan Amerika Robert A. Milikan melakukan eksperimen untuk mengungkapkan lebih banya informasi mengenai elektron. Milikan melakukan eksperimen dengan membuat tetesan minyak mikroskopis yang dapat di berikan muatan listrik menggunakan sinar X. Tetesan minyak ini pada mulanya akan jatuh karena adanya gravitasi. Tetapi proses jatuhnya tetesan minyak tersebut dapat diperlambat atau bahkan dapat dibalikkan dengan medan listrik yang lebih rendah pada peralatan. Dengan menyesuaikan kekuatan medan listrik, mengukur secara cermat serta melakukan perhitungan yang tepat, Milikan dapat menentukan besaran dari muatan dari masing-masing tetesan minyak.

(a)
(b)
 (c)
(c)
Gambar 3. (a),(b) Peralatan percobaan tetesan minyak Milikan, (b) Robert Andrews Millikan
Berdasarkan data yang dikumpulkan oleh Milikan, dapat diketahui bahwa besaran muatan tetesan minyak selalu kelipatan dari muatan sebesar 1.6 x 10−19 C. Milikan menyimpulkan bahwa nilai tersebut merupakan muatan dasar dari satu elektron dengan kelipatannya merupakan muatan yang terdeteksi dari kelebihan satu elektron. Satu elektro (1 x 1.6 x 10−19 C), dua elektro (2 x 1.6 x 10−19 C), tiga elektro (3 x 1.6 x 10−19 C) dan seterusnya. Dengan adanya data muatan elektron oleh Milikan dan rasio muatan terhadap massa oleh Thomson (1.759 × 1011 C/kg) maka massa dari elektron dapat dihitung.
massa elektron =1.6 x 10-19C x 1 kg1.759 × 1011 C/kg= 9.107×10−31 kg
Para ilmuwan saat ini menetapkan bahwa atom tidak dapat dibagi seperti yang diyakini oleh Dalton. Namun berkat dari penelitian J.J. Thomson, Milikan dan yang lainnya partikel subatomic negatif (elektron) dikenal meskipun bagian atom lainnya yang bermuatan positif belum banyak diketahui. Pada tahun 1904, J.J. Thomson mengajukan model atom yang menyerupai roti kismis yang menggambarkan massa bermuatan positif dengan jumlah muatan negatif yang sama dalam bentuk elektron yang tertanam didalamnya. Pada tahun yang sama, Hantaro Nagaoka menyanggah model atom yang diajukan oleh Thomson dengan mengajukan model atom yang menyerupai planet saturnus dimana sebuah bola bermuatan positif di kelilingi oleh halo elektron yang bermuatan negatif.
 Gambar 3. Model Atom J.J. Thomson
Gambar 3. Model Atom J.J. Thomson
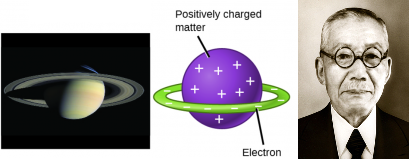
Gambar 4. Model Atom Hantaro Nagaoka
Teori Atom Rutherford
Perkembangan teori atom berikutnya berasal dari Ernest Rutherford seorang fisikawan dari Selandia Baru yang banyak tinggal di Kanada dan Inggris. Rutherford melakukan serangkaian eksperiment dengan menggunakan sinar partikel α (alfa) berkecepatan tinggi bermuatan positiv yang dihasilkan dari peluruhan radioaktif radium. Partikel α terdiri dari dua proton dan dua netron. Rutherford bersama koleganya Hans Geiger dan Ernest Marsden menembakkan seberkas sinar alfa dengan menggunakan alat yang dilapisi timah tebal untuk menahan radiasi pada sebuah lempengan emas yang sangat tipis dan menangkap hamburan yang dihasilkan dengan layar yang dapat berpendar sebentar ketika terkena partikel α.
Dari hasil eksperimen tersebut didapatkan data bahwa, sebagian besar dari partikel α dapat melewati lempengan emas tanpa dibelokkan sama sekali, beberapa dibelokkan sedikit dan terdapat sebagian kecil yang di pantulkan kembali mendekati arah sumber partikel α. Rutherford menggambarkan bahwa penemuan itu merupakan hal yang sangat luar biasa dalam hidupnya.
 (a)
(a)

(b)
Gambar 5. (a) Skema percobaan Rutherford, partikel alfa di tembakkan ke lempengan emas dimana sebagian besar dari sinar α. di teruskan, sebagian dibelokkan sedikit dan sebagian kecil dipantulkan. (b) Rutherford.
Berdasarkan percobaan tersebut kemudian Rutherford menyimpulkan bahwa karena sebagian besar dari partikel α diteruskan tanpa dibelokkan maka pasti pertikel α tersebut bergerak melewati ruang kosong didalam atom. Partikel α bermuatan positif, jadi pembelokkan partikel α dikarenakan partikel tersebut mendekati atau bersinggungan dengan benda bermuatan positif lainnya. Sedangkan partikel α yang dipantulkan dikarenakan telah menabrak benda lain yang memiliki muatan positif yang sangat terkonsentrasi. Karena proses defleksi (proses partikel α di belokkan atau dipantulkan) terjadi hanya sebagian kecil maka muatan positif pada atom hanya menempati sedikit ruang pada lempengan emas. Selanjutnya Rutherford menarik dua kesimpulan yaitu:
- Volume yang ditempati oleh atom harus terdiri dari sejumlah besar ruang kosong
- Sebuah benda kecil yang relatif padat, bermuatan positif yang selanjutnya disebut dengan inti harus berada pada pusat dari pada atom.
Analisa tersebut mengarahkan Rutherford untuk mengusulkan sebuah model atom dimana atom terdiri dari sebuah inti yang sangat kecil bermuatan positif dimana sebagian besar massa atom terkonsentrasi dan dikelilingi oleh elektron bermuatan negatif sehingga atom tersebut netral secara listrik.

Gambar 6. Partikel α mengalami defleksi (pembelokkan/pemantulan) ketika partikel α tersebut bersinggungan atau bertabrakan dengan inti atom bermuatan positif. Dikarenakan inti atom sangat kecil dibandingkan dengan ukuran atom maka hanya sedikit partikel α yang mengalami defleksi. Sebagian besar partikel α melewati ruangan yang ditempati oleh elektron yang sangat ringan.
Setelah melakukan banyak eksperimen, Rutherford juga menemukan bahwa inti dari unsur-unsur lain mengandung inti hidrogen sebagai sebuah blok bangunan. Rutherford menamakan partikel ini dengan sebutan proton yang merupakan partikel sub atom bermuatan positif yang ditemukan didalam inti. Selanjutnya Rutherford mengajukan sebuah model atom dimana Ia menggambarkan atom sebagai inti kecil, padat, bermuatan positif yang disebut dengan nukleus dimana massa atom terkonsentrasi disana yang dikelilingi dengan konstituen menyerupai cahaya bermuatan negatif yang disebut dengan elektron yang beredar pada jarak tertentu seperti planet yang beredar mengelilingi matahari.
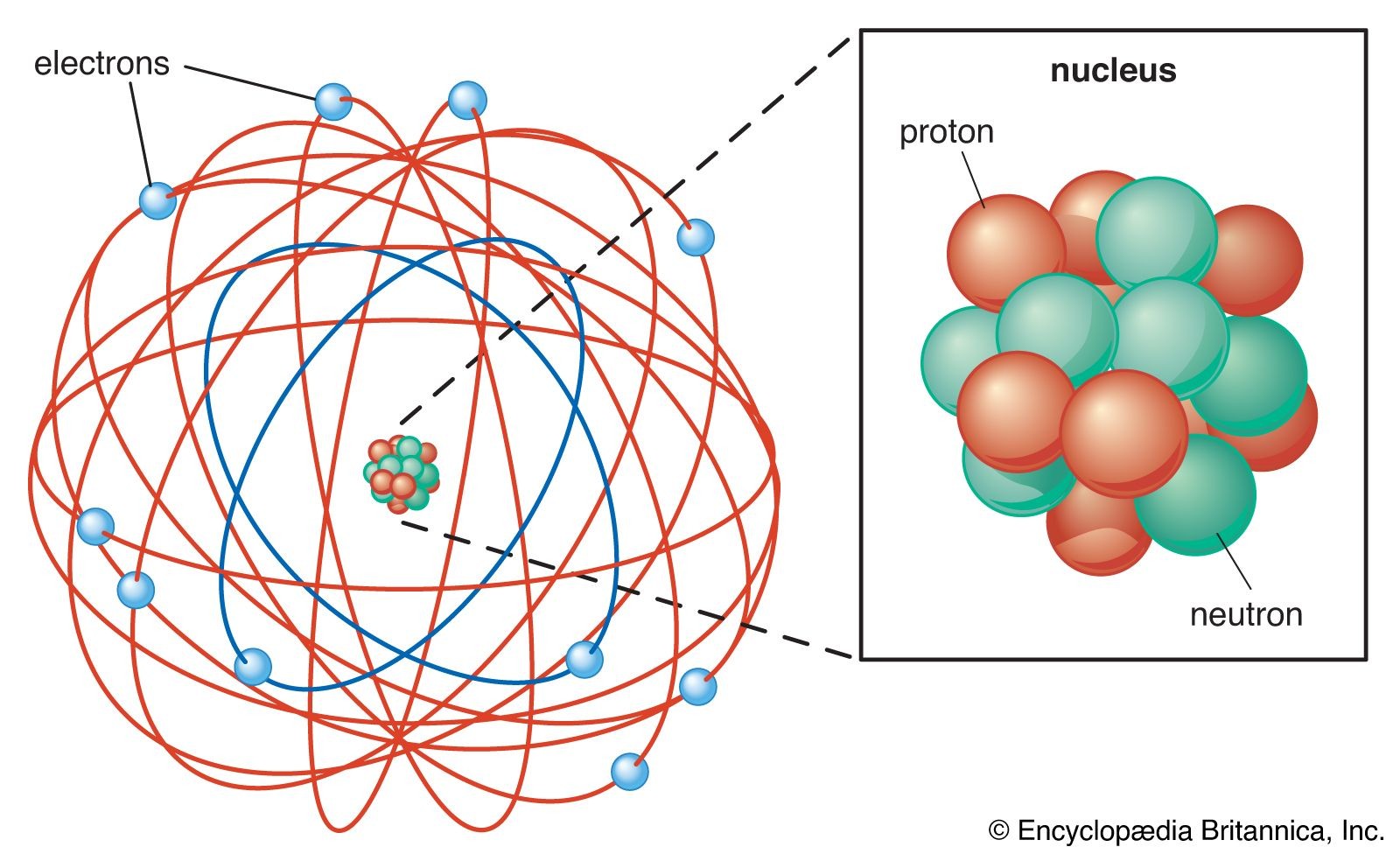
Gambar 7. Model Atom Rutherford, sebuah inti padat bermuatan positif yang dikelilingi dengan elektron yang bermuatan negatif.
Teori Atom Bohr
Teori atom berikutnya dikemukakan oleh seorang ahli fisika berkebangsaan Denmark Niels Bohr (1885-1962) yang mengajukan model atom baru pada tahun 1915. Berdasarkan penemuan spektrum emisi hidrogen dan efek foto listrik. Bohr menyatakan bahwa elektron tidak memancarkan energi pada saat mengelilingi inti atom, tetapi berada dalam kondisi energi konstan yang disebutnya keadaan stasioner. Ini berarti bahwa elektron memiliki jarak yang tetap dari inti atom. Hal tersebut didasarkan pada emisi spektrum hidrogen.


Gambar 8. Spektrum gas hidrogen

Gambar 9. Model atom bohr berdasarkan spektrum gas hidrogen
Bohr menerangkan bahwa elektron dapat berpindah orbit apabila mendapatkan energi dan akan kembali ke orbital asal dengan memancar sejumlah energi yang berkesesuaian dengan kuantum cahaya yang dikenal dengan poton. Hal tersebut pada akhirnya menjadi dasar dari teori kuantum.
Menurut Model atom Bohr yang disering disebut dengan model planet, elektron mengelilingi inti aotm dalam jalur tertentu yang disebut dengan orbit. Ketika elektron berada pada satu salah satu orbital tersebut, maka energinya akan tetap. Keadaan dasar atom hidrogen, dimana energinya paling rendah adalah ketika elektron berada di orbit yang paling dekat dengan inti atom. Orbit yang lebih jauh dari inti atom akan memiliki energi yang lebih besar secara berturut-turut. Elektron tidak diperbolehkan menempati salah satu ruang diantara orbit. Dalam kehidupan sehari-hari ini dianalogikan seperti anak tangga, dimana ketika kita naik atau turun tangga kita hanya dapat menjejakkan kaki pada anak tangga tertentu dan tidak mungkin kita bisa berada diantara anak tangga tersebut. Ketika kita naik anak tangga tersebut maka akan meningkatkan energi potensial kita dan ketika turun anak tangga maka akan menurunkan energi potensial yang kita miliki.
Model atom Bohr menjelaskan data eksperimen atom hidrogen dan dapat diterima secara luas, tetapi juga menimbulkan banyak pertanyaan. Mengapa elektron mengorbit hanya pada jarak tetap yang ditentukan oleh bilangan kuantum n = 1, 2, 3, dan seterusnya, tetapi tidak pernah di antaranya? Mengapa model tersebut bekerja dengan sangat baik dalam menggambarkan hidrogen dan ion satu elektron, tetapi tidak dapat memprediksi dengan tepat spektrum emisi helium atau atom yang lebih besar? Untuk menjawab pertanyaan ini, para ilmuwan perlu untuk merevisi sepenuhnya cara berpikir mereka tentang materi.
Teori Atom Mekanika Kuantum
Teori atom mekanika kuantum adalah sebuah model atom yang didasarkan pada prinsip-prinsip mekanika kuantum. Teori ini dipakai untuk menjelaskan struktur atom dan perilaku partikel-partikel di dalamnya. Dalam teori atom mekanika kuantum, elektron-elektron dalam atom dijelaskan dengan fungsi gelombang, yang merupakan fungsi matematis yang menentukan peluang keberadaan elektron dalam suatu wilayah di sekitar inti atom. Fungsi gelombang ini didasarkan pada prinsip ketidakpastian Heisenberg, yang menyatakan bahwa kita tidak dapat mengetahui posisi dan momentum suatu partikel secara tepat pada saat yang sama. Dalam model ini, posisi dan momentum partikel tidak dapat diketahui secara pasti pada waktu yang sama. Sebagai gantinya, kita dapat menghitung probabilitas untuk menemukan partikel pada lokasi tertentu.
Model mekanika kuantum dapat digunakan untuk melihat transisi elektronik, peristiwa ketika elektron bergerak dari satu tingkat energi ke tingkat energi lainnya. Jika transisi ke tingkat energi yang lebih tinggi, energi diserap, dan perubahan energi bernilai positif. Untuk mendapatkan jumlah energi yang diperlukan untuk transisi ke tingkat energi yang lebih tinggi, sebuah foton diserap oleh atom. Transisi ke tingkat energi yang lebih rendah melibatkan pelepasan energi, dan perubahan energinya negatif. Proses ini disertai dengan emisi foton oleh atom. Persamaan berikut menjelaskan tentang hubungan perpindahan elektron yang didasarkan pada atom hidrogen:
?E = Eakhir - Eawal = - 2.18 x 10-18 1nakhir2 - nawal2 J
Nilai nakhir dan nawal adalah keadaan energi akhir dan awal elektron
Bilangan kuantum utama adalah salah satu dari tiga bilangan kuantum yang digunakan untuk mengkarakterisasi sebuah orbital. Orbital atom, yang berbeda dari orbit, adalah wilayah umum dalam atom tempat elektron paling mungkin berada. Model mekanika kuantum menentukan kemungkinan menemukan elektron dalam ruang tiga dimensi di sekitar inti dan didasarkan pada solusi persamaan Schrödinger. Selain itu, bilangan kuantum utama menentukan energi elektron dalam atom atau ion hidrogen atau mirip hidrogen (atom atau ion dengan hanya satu elektron) dan wilayah umum di mana tingkat energi diskrit elektron dalam multi- atom elektron dan ion berada.
Bilangan kuantum lainnya adalah l, bilangan kuantum momentum sudut. Ini adalah bilangan bulat yang mendefinisikan bentuk orbital, dan mengambil nilai, l = 0, 1, 2, …, n – 1. Ini berarti bahwa orbital dengan n = 1 hanya dapat memiliki satu nilai l, l = 0, sedangkan n = 2 mengizinkan l = 0 dan l = 1, dan seterusnya. Bilangan kuantum utama menentukan ukuran umum dan energi orbital. Nilai l menentukan bentuk orbital. Orbital dengan nilai l yang sama membentuk subkulit. Selain itu, semakin besar bilangan kuantum momentum sudut, semakin besar pula momentum sudut sebuah elektron pada orbital ini.
Orbital dengan l = 0 disebut orbital s (atau subkulit s). Nilai l = 1 sesuai dengan orbital p. Untuk n tertentu, orbital p merupakan subkulit p (mis., 3p jika n = 3). Orbital dengan l = 2 disebut orbital d, diikuti oleh orbital f-, g-, dan h untuk l = 3, 4, 5, dan ada nilai yang lebih tinggi yang tidak akan kita pertimbangkan.
Ada jarak tertentu dari inti di mana kerapatan probabilitas menemukan elektron yang terletak di orbit tertentu adalah nol. Dengan kata lain, nilai fungsi gelombang ψ adalah nol pada jarak ini untuk orbital ini. Nilai radius r seperti itu disebut simpul radial. Jumlah simpul radial dalam suatu orbital adalah n – l – 1.
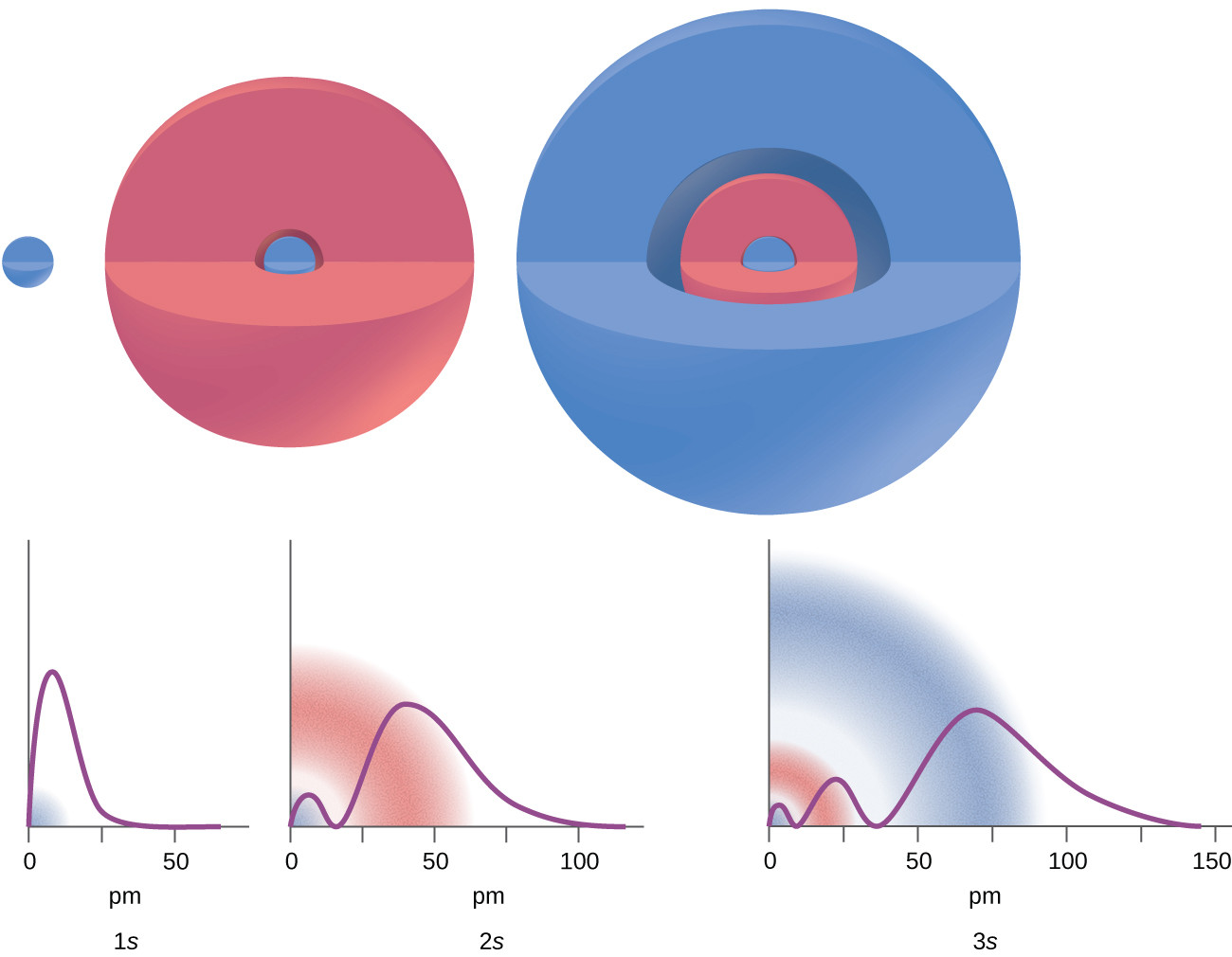 Gambar 10. Grafik menunjukkan probabilitas (sumbu y) menemukan elektron untuk orbital 1s, 2s, 3s sebagai fungsi jarak dari inti.
Gambar 10. Grafik menunjukkan probabilitas (sumbu y) menemukan elektron untuk orbital 1s, 2s, 3s sebagai fungsi jarak dari inti.
Perhatikan contoh pada Gambar 10. Orbital yang digambarkan bertipe s, jadi l = 0 untuk semuanya. Terlihat dari grafik kerapatan probabilitas bahwa terdapat 1 – 0 – 1 = 0 tempat yang kerapatannya nol (node) untuk 1s (n = 1), 2 – 0 – 1 = 1 node untuk 2s, dan 3 – 0 – 1 = 2 node untuk orbital 3s.
Distribusi kerapatan elektron subkulit s berbentuk bola dan subkulit p berbentuk halter. Orbital d dan f lebih kompleks. Bentuk-bentuk ini mewakili wilayah tiga dimensi di mana elektron kemungkinan besar akan ditemukan.
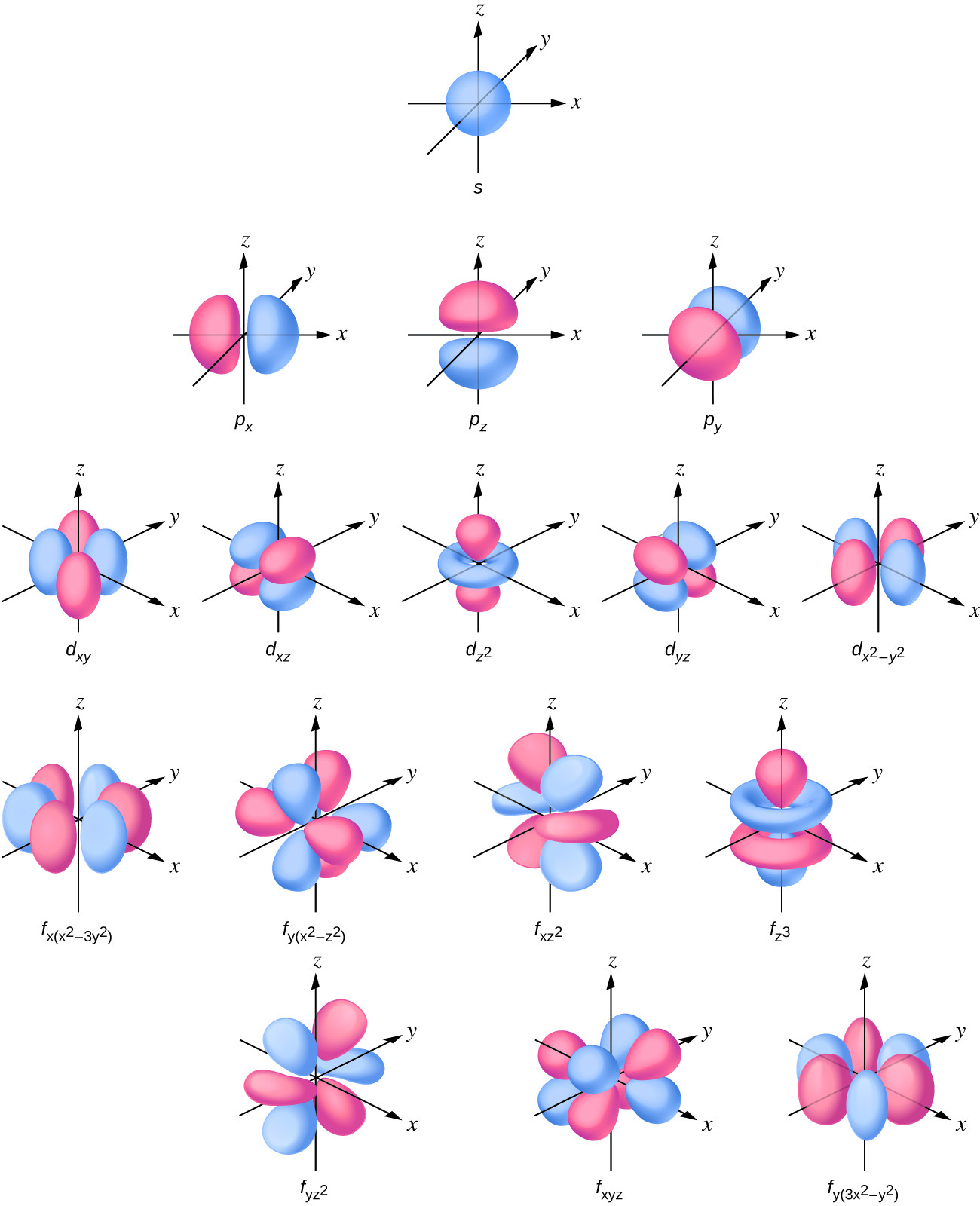
Gambar 11. Bentuk orbital s, p, d, dan f
